au sommaire
Des centaines d'essais cliniques sont menés chaque année en Europe. Ces derniers ont pour but d'évaluer l'efficacité d'une nouvelle moléculemolécule ou d'un traitement, de vérifier ses effets secondaires et sa sécurité. C'est la dernière étape, essentielle, à la commercialisation d'un futur médicament ou protocoleprotocole de soin. Depuis 2004 en Europe, chaque essai clinique doit obligatoirement être inscrit dans un registre EUCTR (European union clinical trials register)), administré par l'Agence européenne de médecine (European medicines agency, EMA). Et suite à une directive de 2012, tous leurs résultats, positifs ou négatifs, doivent faire l'objet d'une publication dans les 12 mois.
La réalité, c'est que près de la moitié (49 %) des essais manquent à la règle, comme le révèle une étude publiée le 12 septembre dans la revue BMJ. Son auteur principal, Ben Goldacre, connaît bien le sujet car il dirige l'Evidence-based medicine DataLab (EBM DataLab), un laboratoire de recherche de l'université d'Oxford qui épluche les données sur les prescriptions, les essais cliniques ou les rétractations scientifiques. Ce dernier a lancé en 2018 le site EU Trials Tracker, qui recense le taux de publication des résultats d'essais cliniques en Europe.
Les grands laboratoires sont les plus vertueux
Pour son étude de BMJ, Ben Goldacre et six de ses collègues ont recensé les 31.821 essais cliniques enregistrés dans la base EUCTR depuis 2004 et ont exclu ceux qui ne correspondaient pas à des critères de publication valables (essais non terminés, date ou pays manquant...). Au final, 7.274 essais ont finalement été retenus. Sur ces derniers, à peine 3.601 ont fait l'objet d'une publication des résultats, soit 49,5 %. L'étude s'est aussi attachée à établir un classement par type de sponsor (l'organisme qui finance l'essai).
Les gros laboratoires privés, comme Alcon, Sanofi, Bayer, Novartis, Servier ou PfizerPfizer, affichent des taux de conformité de plus de 95 %. Tout en bas du classement, les Hôpitaux de Paris n'ont publié aucun des résultats de sept essais dont ils auraient dû rendre compte, tout comme les Hospices civils de Lyon ou l'université de Munich. En règle générale, les essais menés par un laboratoire ou une entité commerciale font l'objet de 68,1 % de publications, tandis que ceux organisés par des institutions non commerciales (universités, hôpitaux, organismes de recherche publique) sont beaucoup moins rigoureux, avec un taux de publication d'à peine 11 %.
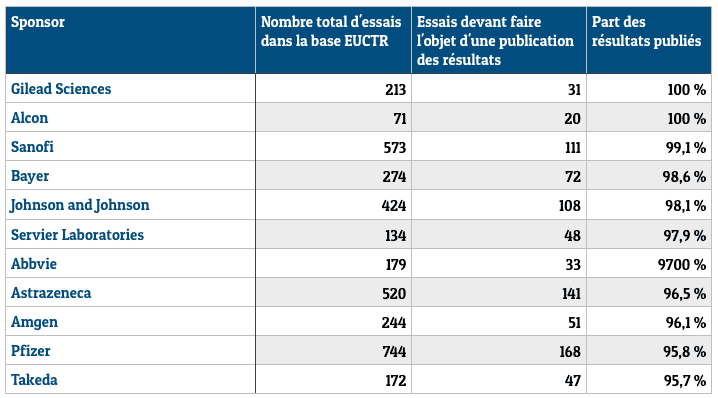
Essais cliniques : laboratoires ayant un taux de conformité de plus de 95 % (sélection). Source : Ben Goldacre et al., BMJ, 2018
En dehors de la non-publication des résultats, les chercheurs mettent aussi en avant les nombreuses « erreurs, omissions et incohérences » du registre. 29,4 % des essais indiqués comme terminés ne comportent aucune date de fin tandis que d'autres mentionnent une date de fin alors qu'ils sont encore en cours dans certains pays.
Comment expliquer un tel fiasco ? Ce n'est apparemment pas par volonté de cacher des conclusions qui n'arrangeraient pas les laboratoires (par exemple démontrant l'inefficacité d'une molécule), puisque ces derniers affichent au contraire des taux de conformité proches de 100 %. Le manque de rigueur s'observant surtout auprès des petits sponsors (ceux qui mènent peu d'essais), il peut s'agir d'un manque de connaissance des procédures ou de la dilution des responsabilités. « Légalement, c'est l'établissement qui finance l'essai qui doit publier les résultats dans la base EUCTR, mais dans les universités, cette tâche est souvent déléguée aux médecins qui ont mené l'étude sur le terrain », explique notamment Ben Goldacre. Autre problème, ceux qui ont supervisé les études datant de plusieurs années (entre 2004 et 2012) sont parfois partis à la retraite ou ont changé de poste. Difficile de retrouver les résultats pour les inclure dans le registre.
“Publier des résultats négatifs, ce n’est pas bon pour ma carrière”
Mais certaines excuses invoquées par les fautifs laissent pantois. « Des études menées il y a 10 ans, ça n'intéresse plus personne », avance l'une des personnes interrogées par les chercheurs. « Je ne suis pas payé pour le temps passé à rapporter des résultats », se plaint un autre. Les auteurs ont même eu droit à « Publier des résultats négatifs, ce n'est pas bon pour ma carrière » ou « C'est MON étude et donc MES résultats m'appartiennent ».
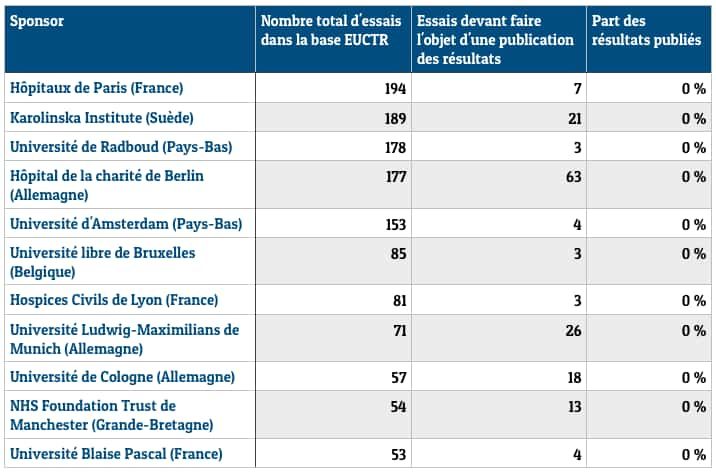
Une impunité totale
Le manque de temps, souvent mentionné, semble lui aussi assez fallacieux. Car si les médecins sont peu enclins à publier leurs résultats dans le registre officiel, ils trouvent en revanche bien le temps d'aller les présenter dans les revues scientifiques prestigieuses ou dans des colloques. Les auteurs ont ainsi extrait de la base EUCTR un échantillon de 100 essais dont les résultats sont absents. Quarante-six d'entre eux avaient pourtant fait l'objet d'un article dans un journal scientifique et cinq dans la « littérature grise » (rapports d'études, pré-publications, thèses, actes de congrès...). « Il est préoccupant de constater que les scientifiques préfèrent publier leurs résultats dans des revues plutôt que dans un registre officiel, dont on peut vérifier les données et où les résultats sont formalisés », déplore Ben Goldacre. Un article peut en effet donner libre cours aux auteurs pour présenter uniquement les résultats qui les arrangent, ou sous une forme plus médiatique et donc biaisée.
Il est également regrettable que ces manquements ne donnent jamais lieu à quelconque sanction : aucune structure n'a jamais été sanctionnée, soupire Ben Goldacre. « Comment se fait-il que des institutions n'ayant jamais publié leurs résultats soient toujours autorisées à mener des essais cliniques ? Et comment se fait-il que des sponsors continuent à les financer ou que les comités d'éthique ne s'en soucient pas ? », s'emporte même Sile Lane, de l'organisation caritative britannique Sense about Science, qui œuvre pour la bonne information des faits scientifiques. « Ce manque de transparencetransparence constitue un véritable problème, car les essais cliniques servent aux médecins, aux patients et aux autorités à prendre des choix éclairés », alerte de son côté Ben Goldacre.
Aux États-Unis, la situation n'est guère plus reluisante. Les résultats des essais cliniques doivent là-bas aussi obligatoirement être publiés sur la plateforme ClinicalTrials.gov, mais il existe de nombreuses exemptions dont les critères sont assez flous. La base présente trop de biais pour être exploitable, d'après Ben Goldacre et ses collègues. Son laboratoire EBM DataLab a tout de même lancé un site similaire à celui pour l'Europe, le FDAAA Trials Tracker. Le taux de conformité s'y élève à 59,4 %, soit 10 points de plus qu'en Europe.
Essais cliniques : la recherche médicale a besoin de nous
Article de Destination Santé publié le 29/04/2010
« On ne peut pas se passer des essais chez l'Homme » : c'est une vérité indubitable de la recherche en médecine. Pourtant les volontaires sont trop peu nombreux, particulièrement en France. Une pénurie dommageable qui a incité à lancer une grande campagne de recrutement.
Le Centre national de Gestion des Essais de Produits de Santé (CENGEPS) lance une campagne « pour mobiliser le grand public à la question de la recherche clinique ». Au-delà de l'information, ses représentants souhaitent surtout améliorer l'image des essais cliniques auprès du public et inciter chacun à s'engager.
D'après un sondage publié dans le cadre de cette campagne, six Français sur dix estiment que les essais cliniques sont « risqués ». Au final, cette crainte conduit 54 % des interrogés à ne pas « envisager de participer personnellement à un essai ».
La campagne du CENGEPS s'appuie surtout sur un nouveau portail InternetInternet, Notre-recherche-clinique.fr. Déroulement des essais étape par étape, enjeux, réglementation, indemnisations, témoignages de participants..., ce site vise surtout à lever les doutes sur le sujet. « On ne peut pas se passer des essais chez l'homme, explique Patrice Jaillon, président du CENGEPS. Certes, des essais sont réalisés sur les animaux pour connaître les effets bénéfiques et les risques toxiques mais on ne peut pas ensuite directement transposer les résultats de l'animal à l'Homme. »
Des essais très surveillés
En France, le recrutement de volontaires pour des essais cliniques est encadré par la loi Huriet-Sérusclat du 20 décembre 1988. Enrichie par des textes successifs (notamment la loi du 9 août 2004), elle garantit le déroulement éthique des essais, qui sont également contrôlés en permanence par les autorités de santé. C'est ainsi que l'Agence française de Sécurité sanitaire des Produits de Santé (Afssaps) est systématiquement tenue informée « des effets indésirables graves et inattendus » pouvant être liés à un médicament expérimental. Elle peut ainsi prendre toute décision les concernant (interdiction, suspension).
A noter enfin que le ministère de la Santé a mis ligne fin 2006, un site Internet dit de référence pour la recherche biomédicale dont l'ambition était justement d'informer patients et professionnels sur la recherche clinique. Malheureusement, ce site ne semble jamais avoir décollé. Quatre ans après sa création, l'espace Particuliers est toujours en constructionconstruction, tout comme le moteur de recherche. Quant à la dernière actualité, elle date du... 27 août 2006.
Ce qu’il faut
retenir
- La moitié des résultats des essais cliniques menés en Europe ne sont jamais publiés dans le registre officiel obligatoire.
- Les grands laboratoires ont un taux de conformité proche de 100 %, mais les institutions publiques sont beaucoup moins rigoureuses.
- Ces manquements ne sont pourtant jamais sanctionnés.